Antwort Wie viele Kohlenstoffatome sind in 12 g Kohlenstoff? Weitere Antworten – Wie viele Atome sind in 12g Kohlenstoff
Periodensystem der Elemente. Ein einzelnes Atom kann man nicht wiegen. Erst eine sehr große Anzahl an Atomen ist für uns erkennbar und wiegbar. Man weiß heute, dass etwa 600 000 000 000 000 000 000 000 = 6∙1023 Kohlenstoff-Atome 12 g wiegen.Der Molwert entspricht der Anzahl der Atome in genau 12 Gramm reinem Kohlenstoff-12. 12,00 g C-12 = 1 Mol C-12-Atome = 6,022 × 1023 Atome • Die Anzahl der Teilchen in 1 Mol wird Avogadro-Zahl (6,0221421 x 1023) genannt.Jahrhunderts nachgewiesen werden. Die Anzahl von Atomen je Mol beträgt 6,022 ⋅ 10 23 (AVOGADRO-Konstante). Damit sind in einem Gramm eines Stoffes ca. 10 22 Atome enthalten.
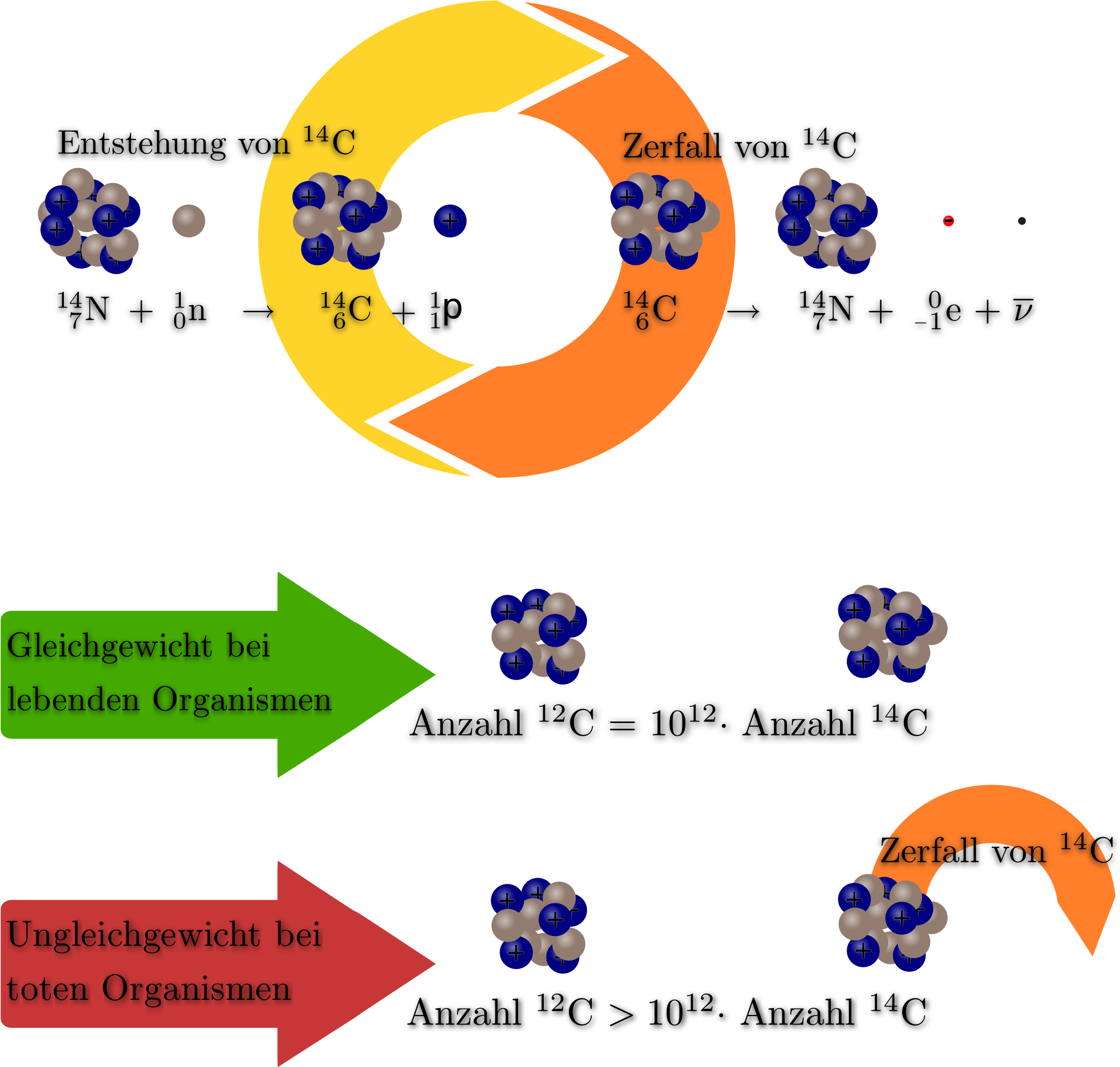
Wie viele Teilchen hat man bei 12 U Kohlenstoff : Das neutrale Atom Kohlenstoff-12 besitzt sechs Protonen, sechs Neutronen und sechs Elektronen; daher hat es eine Massenzahl von 12 (sechs Protonen plus sechs Neutronen). Neutrales Kohlenstoff-14 besitzt sechs Protonen, acht Neutronen und sechs Elektronen; seine Massenzahl ist 14 (sechs Protonen plus acht Neutronen).
Wie viele Atome sind in 12 Gramm C12-Isotop enthalten
(a) 6,022 × 10 23 Atome sind in 12 g Kohlenstoff-12-Element vorhanden.
Was ist Kohlenstoff 12 : Kohlenstoff-12 ist ein stabiles Isotop des chemischen Elements Kohlenstoff, das neben den elementspezifischen 6 Protonen 6 Neutronen im Atomkern aufweist, woraus die Massenzahl 12 resultiert.
For this, we need to recall the actual definition of a unified atomic mass unit, one twelfth of the mass of a carbon-12 atom. This means that the mass of a carbon-12 atom is exactly 12 unified atomic mass units. Therefore, the mass per mole of carbon-12 is 12 grams per mole, meaning moles of carbon-12 atoms.
Von Experten verifizierte Antwort
Ein Mol Kohlenstoff hat die Avogadro-Atomzahl. das bedeutet. daher gibt es 4,99×10²³ Atome in 10 Gramm Kohlenstoff.
Wie viele Atome sind in 4,0 g Kohlenstoff c 12 enthalten
Ihre Proben enthalten nicht 12,0 Gramm, sondern nur 4,00 Gramm. Teilen Sie also 4,00 Gramm durch 12,0 Gramm und Sie erhalten 0,3 Wiederholungen oder 1/3 Mol Kohlenstoff. Ein Mol Kohlenstoff enthält 6,02 x 10^23 (Avogadro-Zahl) Kohlenstoffatome. Multiplizieren Sie also die Avogadro-Zahl mit 1/3 und Sie erhalten 2,006 sich wiederholende x 10^23 Kohlenstoffatome.Wenn wir also 1 g Kohlenstoff haben, berechnen wir die Anzahl der Mol, indem wir die Masse des Kohlenstoffs durch seine Molmasse dividieren. Somit ist 1g / 12,0 g/mol = 0,0833 mol. Daher enthält 1 g Kohlenstoff etwa 0,0833 Mol Kohlenstoff.Genau 12 Gramm reines Kohlenstoff-12-Pulver werden als ein Mol bezeichnet. Die Anzahl der Kohlenstoff-12-Atome in dieser Ein-Mol-Probe beträgt 6,022 136 7 x 1023. Diese Zahl ist als Avogadro-Zahl bekannt.
12 g C-12 enthalten 6,022×1023 Kohlenstoffatome.
Woraus besteht Kohlenstoff 12 : Kohlenstoff-12 ist von besonderer Bedeutung, da es als Standard zur Messung der Atommassen aller Nuklide verwendet wird. Daher beträgt seine Atommasse per Definition genau 12 Dalton. Kohlenstoff-12 besteht aus 6 Protonen, 6 Neutronen und 6 Elektronen .
Was ist die 12 in Kohlenstoff 12 : Kohlenstoff-12: mit 6 Protonen und 6 Neutronen und einer Atommasse von 12.
Wie viele Atome enthält eine 24-g-Kohlenstoffprobe
Die Kohlenstoffmasse beträgt 24g. 6,022×1023 Atome. Die Anzahl der Atome in 24 g Kohlenstoff kann nun wie folgt berechnet werden: 24g× (6,022 × 1023 Atome) / 12g = 12,04 × 1023 Atome .
Die Molmasse von Kupfer beträgt 63,55 Gramm/Mol. Wenn wir also die Masse der Münze (12,0 Gramm) durch die Molmasse dividieren, erhalten wir die Anzahl der Mol (0,1888 Mol). Wenn wir dies mit der Avogadro-Zahl multiplizieren, erhalten wir, dass die Münze etwa 1,135 x 10^23 Kupferatome enthält.Die Idee hier ist, dass 1 kg-Mol 103 Mol entspricht. Dies ist der Fall, weil ein Mol einer Substanz eine Anzahl von Partikeln dieser Substanz enthalten muss, die der Anzahl der Atome entspricht, die in genau 12 g Kohlenstoff-12 vorhanden sind.
Warum sind 12 g Kohlenstoff 12 ein Mol : Warum 12 Gramm verwenden Dies ist die theoretische Atommasse des Kohlenstoff-12-Isotops (6 Protonen und 6 Neutronen) . Das bedeutet, dass die Atommasse bzw. das Atomgewicht (12 Gramm) von Kohlenstoff genau 1 Mol Kohlenstoff entspricht.