Antwort Ist C-12 ein Isotop? Weitere Antworten – Warum ist 12c ein Isotop
Daten und Eigenschaften des Isotops C-12.
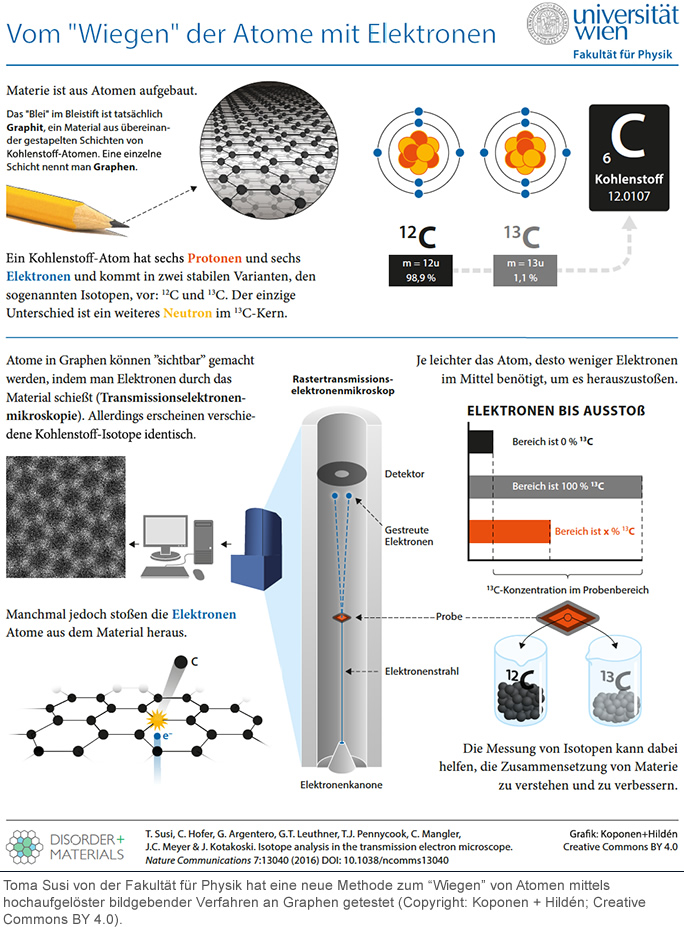
Kohlenstoff-12 ist ein stabiles Isotop des chemischen Elements Kohlenstoff, das neben den elementspezifischen 6 Protonen 6 Neutronen im Atomkern aufweist, woraus die Massenzahl 12 resultiert.Da die chemischen Atomgewichte von Kohlenstoff 12 denen der natürlichen Sauerstoffmischung nahezu entsprechen , wurde es als Standard ausgewählt. Denn außer Kohlenstoff-12 hat kein anderes Nuklid auf dieser Skala eine identische ganzzahlige Masse. Sechs Protonen, sechs Neutronen und sechs Elektronen bilden Kohlenstoff-12.Sie wird in der Regel in atomaren Masseneinheit oder u ausgedrückt. Definitionsgemäß besitzt ein Kohlenstoffatom mit sechs Neutronen, Kohlenstoff-12, eine Atommasse von 12 u. Andere Atome haben normalweise aus Gründen, die ein wenig über den Rahmen dieses Artikels hinausgehen, keine runden Atommassen.

Welche Elemente sind Isotope : Welche Elemente sind Isotope Isotope können von jedem chemischen Element existieren. Sie sind Varianten eines Elements, die in der Anzahl der Neutronen im Atomkern variieren, während sie die gleiche Anzahl von Protonen aufweisen.
Was definiert ein Isotop
Isotope sind Atome eines Elements, mit gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl. Elemente mit natürlich vorkommenden Isotopen nennst Du Mischelemente. Elemente ohne natürlich vorkommende Isotope nennst Du Reinelemente.
Wann sind Isotope : Man spricht von Isotopen, wenn zwei Atome gleich viele Protonen haben, also dem gleichen Element angehören, aber eine unterschiedliche Zahl von Neutronen haben, also eine unterschiedliche Massenzahl aufweisen.
Das mit Abstand häufigste Kohlenstoffisotop ist Kohlenstoff-12 ( 12 C) , das neben seinen sechs Protonen auch sechs Neutronen enthält. Das nächstschwerere Kohlenstoffisotop, Kohlenstoff-13 ( 13 C), hat sieben Neutronen.
But atoms of the same element can possess different numbers of neutrons in their nuclei. These different forms are known as isotopes. Carbon has three main isotopes: carbon-12, carbon-13 and carbon-14.
Was bedeutet c12
Kohlenstoff-12 ist von besonderer Bedeutung, da es als Standard zur Messung der Atommassen aller Nuklide verwendet wird. Daher beträgt seine Atommasse per Definition genau 12 Dalton. Kohlenstoff-12 besteht aus 6 Protonen, 6 Neutronen und 6 Elektronen.Kohlenstoff-12 ( 12 C): Das Kohlenstoffisotop, dessen Kern sechs Protonen und sechs Neutronen enthält. Dies ergibt eine Atommasse von 12 amu. Der Kern von Kohlenstoff-12 enthält sechs Protonen und. sechs Neutronen, was eine Atommasse von 12 amu ergibt. Der Kern von Kohlenstoff-13 enthält sechs Protonen und.Isotope sind verschiedene Arten von Atomen eines Elements, die unterschiedliche Atommassen haben . Beispielsweise gibt es drei Kohlenstoffisotope: Kohlenstoff-12, Kohlenstoff-13 und Kohlenstoff-14. Sie haben Atommassen von 12, 13 bzw. 14.
Was sind Isotope Isotope sind Atome eines Elements, die eine gleiche Anzahl von Protonen und Elektronen haben, sich jedoch in der Anzahl von Neutronen unterscheiden. Der Unterschied der Neutronenanzahl führt zu einer unterschiedlichen Atommasse.
Was sind Beispiele für Isotope : Eine Isotopengruppe eines beliebigen Elements hat immer die gleiche Anzahl an Protonen und Elektronen. Sie unterscheiden sich in der Anzahl der Neutronen, die in ihren jeweiligen Kernen enthalten sind. Ein Beispiel für eine Gruppe von Isotopen ist Wasserstoff-1 (Protium), Wasserstoff-2 (Deuterium) und Wasserstoff-3 (Tritium) .
Was ist ein Isotop mit Beispiel : Die Herstellung von Isotopen erfolgt durch den Beschuss dieser mit freien Neutronen. So entstehen etwa Uran A 92 235 A 2 92 2 235 U Isotope. Ein Uran A 92 235 A 2 92 2 235 U Isotop wird mit einem Neutron A 1 A 2 2 1 n beschossen. Dadurch entsteht ein Uran A 92 236 A 2 92 2 236 U Isotop.
Wie identifiziert man Isotope
Isotope werden auf verschiedene Arten notiert. Am häufigsten werden sie durch den Namen oder das Symbol des jeweiligen Elements angegeben, unmittelbar gefolgt von einem Bindestrich und der Massenzahl (z. B. Kohlenstoff-14 oder C-14).
Instead of hydrogen or oxygen,the isotope of carbon having 6 protons and 6 electrons was given an exact mass of 12(instead of 12.011) and used as a reference. It was a good choice, since it was in between the two previously used standards, and meant that nothing had to change too much.In der Regel besitzt jedes natürlich vorkommende Element ein oder wenige stabile Isotope, während seine übrigen Isotope radioaktiv (das heißt instabil) sind und früher oder später zerfallen. Es gibt jedoch auch Elemente, bei denen alle Isotope instabil sind.
Was ist der Unterschied zwischen C 12 und C 14 : Ein Isotop ist eine Variante eines chemischen Elements, die sich in der Anzahl der Neutronen im Atomkern unterscheidet. Beispielsweise hat das C14-Isotop zwei Neutronen mehr als das stabilere C12-Isotop. Deshalb ist C14 radioaktiv und zerfällt über die Zeit, während C12 stabil bleibt.



